Up to 50% off!
Don't miss out on some very special items at extraordinary sale prices. For a limited time!
With code: SUMMERSALE

Thermomètre
👉 Voir tous les thermomètres
Oxymètre
👉 Voir tous les oxymètres
Tensiomètre
👉 Voir tous les tensiomètres
Bijoux Bohème


Hippocrate & Pindare : Expert en matériel médical
Hippocrate & Pindare est une entreprise de matériel médical qui vend des équipements de qualité supérieure aux professionnels et aux particuliers du monde entier. Nous proposons une large sélection de produits pour votre commodité, tels que des thermomètres, des oxymètres et des tensiomètres.


Produits innovants
Avec des dizaines de produits innovants, vous trouverez ce que vous cherchez dans notre magasin.

Support réactif
Nous ne nous reposons pas tant que chaque problème n’est pas résolu.
Paiement sécurisé
Grâce à la sécurité SSL 128 bits, vous avez la garantie que vos achats sont sécurisés du début à la fin.
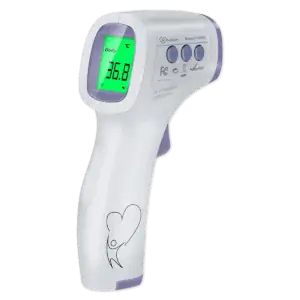
Quel thermomètre choisir ?
Il existe différents types de thermomètres pour mesurer la température :
- Le thermomètre frontal est le type de thermomètre le plus couramment utilisé aujourd’hui. L’appareil utilise la lumière infrarouge pour mesurer la température au centre de votre front, et il prend une lecture en quelques secondes.
- Les thermomètres auriculaires sont également utilisés dans de nombreuses situations, mais il y a des situations où ils ne peuvent pas être utilisés, comme lorsque le conduit auditif est bloqué ou s’il y a de la cire dans l’oreille.
Oxymètre : L’appareil qui sauve des vies
Un oxymètre est un appareil médical qui mesure le niveau de saturation en oxygène du sang. Il est utilisé pour détecter et diagnostiquer des conditions telles que l’embolie pulmonaire, la maladie coronarienne, les crises cardiaques et les accidents vasculaires cérébraux. C’est un appareil non invasif qui est placé sur l’index ou le lobe de l’oreille.
Tensiomètre : L’outil indispensable
Le tensiomètre est un instrument utilisé pour mesurer la pression artérielle systolique, ou supérieure, et diastolique, ou inférieure, d’une personne. Il utilise généralement un brassard gonflable autour de la partie supérieure du bras pour bloquer le flux sanguin tandis que la pression de l’air est progressivement relâchée.

Votre santé. Notre engagement !
L’équipement médical est une partie importante et nécessaire de notre système de santé. Il aide les médecins à mieux diagnostiquer et traiter les patients. C’est pourquoi il est vital que nous ayons accès à ces appareils aussi bien pour les particuliers que pour les professionnels de santé à travers le monde.
Certains équipements médicaux ont été spécialement conçus pour être utilisés par des particuliers, comme les thermomètres, les tensiomètres et les oxymètres de pouls. D’autres dispositifs médicaux sont utilisés exclusivement par des professionnels de la santé tels que les appareils à rayons X, les scanners CAT, les scanners IRM, les ultrasons, etc. Les équipements médicaux ont leur place chez les personnes malades ou à risques ou dans les hôpitaux avec du personnel formé qui sait les utiliser en toute sécurité.

H & P
Offer of the week!
Outdoor essentials from legendary designer Tom Woo available at 25% off for one week only. Don't miss out on this incredible deal!

Brands we stock
We pick the very best so you can be assured of the quality. There can be no compromises when it comes to materials, ease of wear, and durability.